5月15日,亿帆医药召开艾贝格司亭 α 注射液(中国商品名“亿立舒@”,内部研发代码“F-627”,以下简称“亿立舒”)获批上市现场说明会。本次说明会就亿立舒研发历程、临床价值、中国获批历程、中国销售策略、美国 /欧洲申报进展、全球商业开发进展,以及在研产品 F-652 研发进展和在研管线等情况进行了详细说明。据统计,现场有77家基金机构共计150人参与。
值得关注的是,亿立舒目前已签署超30个国家或地区的商业化合作协议,未来有望成为国内首个走向全球100多个国家或地区的大分子创新药。
亿立舒上市,大分子创新药成果走向全球化
在大分子生物药方面,亿帆医药是国内为数不多的就同一产品向美国、欧洲和中国递交生物制品新药上市申请的中国企业之一。5月9日,亿立舒成功在国内获批上市,拿下创新药进展的一个重要里程碑,也打开了亿帆医药大分子生物创新药全球化上市的一扇“大门”。
亿一生物执行总裁耿雨红博士表示,目前亿立舒已处于美国和欧洲上市申请的后期审评阶段,预计美国FDA和欧洲EMA将分别于今年5月底、8月对北京亿一的亿立舒上市申请进行原液现场核查。目前北京亿一基于PIC/S(国际药品认证合作组织)质量体系要求,通过自查、内审,第三方审计进行持续法规符合性分析,确保质量体系的合规性,力争尽快获得美欧上市批件。
据了解,亿立舒是基于亿一生物具有自主知识产权Di-KineTM双分子技术平台开发的治疗用一类生物制品新药,是基于Fc融合蛋白技术,由CHO细胞表达的rhG-CSF二聚体,具有长效和强效的生物学特点。该药物用于预防和治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症,为辅助肿瘤治疗的常规手段。
根据药监局核准的药品说明书及亿立舒在中国、欧洲及美国分别开展的三项 III 期临床试验结果显示,在一些具有临床意义的指标上,亿立舒临床疗效优于临床上原研短效升白药(非格司亭)和长效升白药(培非格司亭 Neulasta)。
亿一生物首席执行官李锡明博士在说明会上表示,亿立舒的中国获批,证明了亿一生物及公司已具备独立完成创新生物药立项、研发、临床、注册申报、生产及商业化的能力,并形成一套完整且成熟的体系,有利于亿一生物及公司后续创新生物药的持续开发和成果转化。同时也为即将到来的FDA和EMA的现场核查和最终获批提供了宝贵经验,增强了信心,为尽快实现亿立舒创新成果全球化奠定了基础。
备战商业化,全球市场规模潜力巨大
根据弗若斯特沙利文预测,中国长效GCSF类药物在2025年预计达到102.70亿元的销售规模,在2030年将达到135.37亿元。据了解,2021年,亿帆医药在国内已选定与正大天晴签署合作推进亿立舒的商业化。2022年6月,正大天晴增加里程碑款3200万。依靠其母公司中国生物医药,覆盖全国32省超15000家医院和医疗机构的庞大销售网络,预计新药上市后将加速放量。
业内人士指出,一方面,由于亿立舒具备持续保护、不易致敏和更早给药的特点,正大天晴将根据其差异化优势,采用擅长的学术推广模式,在全国重点省市开启“备战”宣传,巩固境内首个三代 G-CSF 形象;另一方面,国内合作方正大天晴拥有成熟的创新药推广体系销售团队可同时销售泛癌种药物,很多科室和大部分目标客户一致,通过交叉销售提高销售效率,并在潜力大的核心市场,投入销售力量抢夺市场份额。
另外说明会提及,亿立舒将积极参加今年的国家医保谈判。参考国内同类产品历史情况,若能纳入医保目录将大幅加快亿立舒的市场销量。
以恒瑞医药的艾多(长效G-CSF)为例。2018年5月上市,2019年被纳入医保目录后大幅放量,2020年销售额便达4.96亿元,2021年上半年更是快速提升到4.12亿元。根据Wind数据,2018-2021年,艾多的样本医院销售额从267.91万元增加至8.36亿元,期间CAGR高达578%。
全球商业化方面,亿立舒已在美国等30余个国家或地区签署商业化合作协议。未来有望成为首个大分子创新药走向全球100多个国家或地区的产品,努力成为G-CSF的领导者。
根据IQVIA数据统计,2022年G-CSF全球市场份额超过60亿美元,其中长效G-CSF销量年均增长率是短效G-CSF的2倍,除中国以外的全球长效G-CSF销量年均增长率11%,在新兴发展中国家的增速更快;同时,根据 2019 年《柳叶刀肿瘤学》在线发表一项基于人口学的研究预测,至2040年全球癌症患者约2600万人,预计全球将可能完成7500万次化疗,按照美国癌症患者的化疗治疗过程中70%使用长效G-CSF来折算,未来全球长效G-CSF市场的潜力仍然巨大。
在研管线丰富,未来新药报批进入快车道
据亿一生物官网显示,公司在研大分子生物药有4款,大多以全球商业化为目标。其中,F-899中国Ⅰ期临床已完成,F-652两款适应症美国Ⅱa期临床已完成、一款适应症进入中国Ⅱ期临床,亿立舒在中国获批上市,美国、欧盟上市后期审评中。
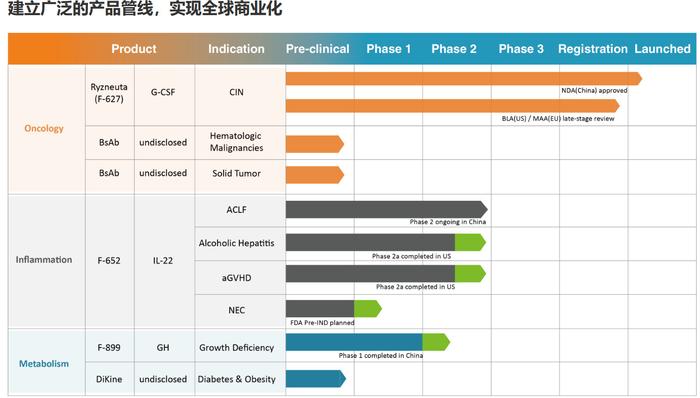
亿一生物大分子研发管线
亿一生物首席科学官孙丽萍博士表示,亿一生物产品研发规划继续发挥Fc融合蛋白DiKine 平台的成熟技术,结合抗体技术开发长效双特异性或多特异性抗体,聚焦 Best-in-class 和 First-in-class 产品,目前临床前有3个新产品。
公司在说明会上表示,亿一生物拥有丰富的在研产品管线,过去的一年主要围绕新实验室的搭建和团队扩展,希望从2024-2025年开始有不断的新项目进入IND报批阶段。
据了解,亿帆医药的另一重磅创新药产品——F-652,是公司首个具备first in class的创新药产品,目前潜在市场空间超50亿美元。F-652目前在研的适应症有4个,分别为慢加急性肝衰竭(ACLF)、酒精性肝炎、急性移植物抗宿主病、新生儿坏死性肠炎。其中,ACLF适应症目前进展最快,现在IIa期三个剂量组病人已经全部完成入组,预计将于2023年Q3完成数据统计。如果该数据达到预设目标,将与药监部门沟通,确定后续临床计划。
F-652首创药的潜力和独家的市场空间,也受到中国生物制药的关注。中国生物制药投资管理部总监李赫表示,亿一生物与中国生物制药在战略上均聚焦创新和解决患者未被满足的市场需求,中国生物制药前期投资2000万美元认购亿一生物股份,是继取得亿一生物在研产品亿立舒中国商业化权益的又一次合作,也对F-652在肝病领域方面非常关注及合作意愿。
上海证券研报指出,公司医药自有品种增速亮眼,产品结构持续优化,国际事业部不断拓展新产品新市场;F-627近期迎FDA现场检查,全球化商业就绪,上市销售后有望成为公司又一业绩增长点。


